*****TOUTE REPRODUCTION, EN TOUT OU EN PARTIE, SOUS QUELQUE FORME QUE CE SOIT, EST INTERDITE SANS L'AUTORISATION PRÉALABLE DE SAULES QUEBEC ... TOUTE AUTRE UTILISATION, REPRODUCTION, DIFFUSION, PUBLICATION OU RETRANSMISSION DU CONTENU EST STRICTEMENT INTERDITE SANS L'AUTORISATION ÉCRITE DU DÉTENTEUR DES DROITS D'AUTEUR ASSOCIÉS À L’ENSEMBLE DE CE SITE ET LES PUBLICATIONBS LUI ÉTANT ASSOCIÉES*****
Consultez notre répertoire des maladies et conditions pouvant affecter vos saules et comment les aider retrouver la forme.
Cliquez sur l’image qui selon vous est la plus représentative de ce que pourrait être la maladie qui afflige vos pousses.
Le Chancre du Botryosphaeria
Introduction
Les saules (Salix spp.) sont sensibles à plusieurs chancres qui provoquent la brûlure des nouvelles pousses et l’annélation des branches et des tiges. Les chancres initiés par un complexe de champignons du genre Botryosphaeria semblent être les plus fréquents dans les plantations de saules à rotation courte de l’État de New York.
Ces champignons sont des agents pathogènes opportunistes qui provoquent des chancres sur les branches, les tiges et/ou les rameaux, ainsi que le dépérissement des saules sensibles.
L’infection se produit souvent lorsque les arbustes de saules sont prédisposés par des facteurs de problèmes environnementaux (par exemple, la sécheresse et les dégâts causés par le gel), la défoliation par les insectes ou les blessures.
Une caractéristique déroutante des différentes espèces de Botryosphaeria est que beaucoup d’entre elles ont des stades asexués qui sont morphologiquement très différents des autres espèces du même genre.
Malgré que les stades sexuels des deux principaux pathogènes du saule à New York présentent de nombreuses similitudes, leurs stades asexués sont nettement différents. Par conséquent, les espèces de Botryosphaeria sont souvent impossibles à distinguer sans identification moléculaire.
Deux espèces, B. dothidea et B. ribis, sont connus comme étant des agents pathogènes du saule dans l’est des États-Unis. Par conséquent, les informations fournies ici sont spécifiquement pour B. dothidea et B. ribis.
Notes et distribution
Le Botryosphaeria dothidea et le B. ribis retrouve partout dans le monde ayant aussi plusieurs hôtes. Ces champignons sont collectivement connus pour attaquer environ 170 espèces de plantes, y compris des angiospermes ligneuses et des espèces de conifères.
Les registres historiques de l’est des États-Unis indiquent que le B. ribis a été collecté sur la pomme, le groseillier, le sureau, l’orme, le raisin, le marronnier d’Inde, le chêne, la poire, la rose, le sweetgum, le magnolia tulipe, le noyer et le saule. Parait-il que jusqu’à présent deux espèces, S. eriocephala et S. purpurea, dans les plantations à courte rotation, sont les seuls saules trouvés sensibles au B. dothidea et au B. ribis.
Ces deux champignons attaquent le plus souvent des arbustes ou des arbres stressés. Par conséquent, le nombre réduit d’hôtes affectés que l’on trouve actuellement dans les plantations de saules à New York est probablement du aux directives de gestion établies par les scientifiques concernant les préférences du sol pour la production de saules, les procédures de préparation du site, la lutte contre les parasites et la sélection d’espèces/clones de saules vigoureux comme matériel sur pied
Signes et symptômes
La taille et la forme des chancres provoqués par le B. dothidea ou le B. ribis varient considérablement en fonction de l’espèce porteuse, des tissus attaqués et de la vitalité de l’hôte. Les chancres sont généralement discrets, de forme ovoïde à allongée, déprimés et associés à une branche ou un rameau mort. Le contexte interne du chancre se trouvant sur des tiges vertes lisses, est brun clair à noir et a un aspect rugueux dû à l’émergence de fructifications noires.
Les vieux chancres peuvent défigurer les tiges et ils apparaissent comme de larges renflements centrés sur des rameaux ou des branches précédemment tuées. Les restes d’une brindille ou d’une branche restent souvent attachés à la partie interne du chancre. On peut également trouver des fructifications asexuées sur la branche ou sur le rameau attaché et à l’intérieur de la surface rugueuse du chancre.
Le bois situé sous les nouveaux et les anciens chancres est brun orangé lorsqu’il est exposé à l’aide d’un scalpel ou d’un couteau aiguisé. Cette décoloration s’étend sur plusieurs centimètres au-delà de la limite du chancre et indique une colonisation du bois par le Botryosphaeria.
Des fructifications noires asexuées (pycnides) apparaissent sur l’écorce malade peu après l’infection et dans les chancres apparus l’année précédente. Les pycnides sont encastrées dans des stromates noirs (1-4 mm aux points les plus larges) et sont facilement visibles sans loupe.
Une coupe transversale du stroma noir révèle plusieurs cavités blanches (locules). Les conidies de B. dothidea et de B. ribis sont incolores (hyalines) et unicellulaires (unicellulaires). Les conidies de B. dothidea sont étroitement fusiformes, mesurent 23-25 x 4-6 µm et ayant une base un peu arrondie. Les conidies de B. ribis sont également fusiformes à base arrondie et mesurent 19-23 x 5-6 µm à maturité.
Bien que le stade sexuel de l’un ou l’autre champignon soit rare sur les tissus végétaux infectés, les fructifications sexuelles (périthèces) sous forme de flask accompagnent les pycnides ou se forment séparément dans le stroma fongique intégré à l’écorce malade. Contrairement aux spores asexuées, les caractéristiques des périthèces et des spores sexuelles (ascospores) produites par le B. dothidea et le B. ribis sont presque impossibles à distinguer. Les périthèces du B. dothidea et du B. ribis ont un diamètre de 200-500 µm et 100-400 µm, respectivement, et ont des parois multicouches (5-15 couches). Les ascospores du B. dothidea sont unicellulaires, claires, fusiformes à ovoïdes, et mesurent environ 19-24 x 7-8 µm. De même, les ascospores de B. ribis sont unicellulaires, hyalines, fusiformes à ellipsoïdes, et ont souvent des extrémités arrondies, et mesurent 18-23 x 6-8 µm.
Cycle de maladie
La pathogénèse du B. dothidea et du B. ribis sur le saule commence par la colonisation des branches et des rameaux blessés ou tués par d’autres causes. Ces champignons sont capables de coloniser les parties mortes ou blessées de la plante ainsi que les ouvertures naturelles (par exemple, les lenticelles et les fissures de l’écorce) et y restent latents jusqu’à ce que l’hôte soit stressé par les conditions environnementales, la concurrence, les blessures causées par les insectes ou les dommages mécaniques.
Les champignons Botryosphaeria tels que B. dothidea et B. ribis produisent des enzymes de dégradation de la paroi cellulaire qui contribuent à leur potentiel de colonisation et leur donnent la possibilité de vivre et de se reproduire sur des tissus morts tout en colonisant des tissus vivants. Les conidies sont produites dans les pycnides peu après l’infection et sont dispersées par le vent et la pluie vers de nouveaux hôtes où elles germent et colonisent les ouvertures naturelles ou les plaies créées dans l’écorce des hôtes sensibles.
Les conidies germent en présence d’une forte humidité ou d’eau libre lorsque les températures le permettent (24-30C). La température optimale pour la croissance in vitro des colonies de champignons Botryosphaeria se situe entre 25° et 35° C ; par conséquent, l’infection est plus grande en temps humide en été ou lorsque les plantes parteuses sont soumises à un stress thermique. Les ascospores sont disséminées par le vent et lavées par la pluie dans les ouvertures naturelles ou les plaies.
Dommage
Les cycles de rotation actuellement prescrits dans les plantations de saules de l’État de New York se situent entre deux et trois ans après le taillis. Par conséquent, des dommages considerables aux rendements des cultures que peut causer ces agents pathogènes ont probablement été contrôlés ou limités par l’âge de la rotation.
Si les saules sont cultivés selon des cycles de rotation ≥ 4 ans, l’infection continue des saules sensibles peut entraîner le développement de chancres d’annélation, un dépérissement considérable, la mort de la tige ou la mortalité des selles. Pour éviter le développement des chancres de Botryosphaeria, il convient de planter des saules à croissance vigoureuse et résistant a la sécheresse. La réduction des dégâts causés par les insectes et l’élimination des branches ou des tiges infectées peuvent également réduire la propagation de cette maladie.
Références sélectionnées
Crous, P. W., B. Slippers, M. J. Wingfield, J. Rheeder, W. F.O. Marassas, A. J.L. Philips, et al. 2006. Lignées phylogénétiques chez les Botryosphaeriaceae. Etudes en Mycologie 55:235-253. Shear, C. L., N. E. Stevens, et M. S. Wilcox. 1925. Le Botryosphaeria et le Physalospora dans l’est des États-Unis. Mycologie 17:98-107. Sinclair, W. A. et H. H. Lyon. 2005. Maladies des arbres et des arbustes. 2me Edition, Presse Universitaire de Cornell. Ithaca, NY, USA. pp 120. Slippers, B., P. W. Crous, S. Denman, T. A. Coutinho, B. D. Wingfield, et M. J. Wingfield. 2004. Des généalogies multiples combinées et des caractères phénotypiques différencient plusieurs espèces précédemment identifiées comme Botryosphaeria dothidea. Mycologie 96:83-101. Sutton, T. B., et L. F. Arauzl. 1991. L’influence de la température et de l’humidité sur la germination des ascospores et des conidies de Botryosphaeria dothidea. Maladie des plants 75:1146-1149. Wolf, F. T., et F. A. Wolf. A study of Botryosphaeria ribis on willow.sur le saule. Mycologie 31:217-227. Shawn C. Kenaley1, George W. Hudler1, Dawn Dailey O’Brien1, Kimberly D. Cameron2, et Lawrence B. Smart2,* Département de pathologie végétale et de biologie des plantes et des microbes, Université de Cornell, Ithaca, Département de l’horticulture, Université de Cornell, Station d’expérimentation agricole de l’État de New York, Genève, NY


Le Chancre Noir
Introduction
Le chancre noir du saule (Salix spp.) est causé par le champignon Glomerella miyabeana (Glomerellaceae). En Amérique du Nord ainsi qu’en Europe, l’agent pathogène du chancre noir est systématiquement associé au champignon de la tavelure du saule (Venturiaceae : Venturia saliciperda) ; ensemble ils produisent une maladie grave du saule connue sous le nom de “brûlure du saule”.
Le rôle que joue le G. miyabeana et le V. saliciperda en tant que pathogènes primaires au sein du complexe de la brûlure du saule non pas été déterminés, malgré que plusieurs études d’inoculation ont déjà comparé les effets nocifs de ces champignons.
Le champignon du chancre noir apparait sur les tissus végétaux malades à mi-chemin de la saison de croissance (juillet, août) et peur être aperçu sur les feuilles et les rameaux touchés précédemment par le champignon de la tavelure du saule. Cependant, le G. miyabeana est généralement considéré par les phytopathologistes comme un pathogène du saule plus virulent que V. saliciperda et est capable de détruire tres rapidement vos feuilles vertes et vos rameaux.
Notes et distribution
Le chancre noir a déjà été aperçu dans tout l’est des États-Unis, les Grands Lacs, au nord-ouest du Pacifique et a la province de Colombie-Britannique. La majorité des informations sur les porteurs potentiels en Amérique du Nord pointent tous vers les saules cultivés comme arbres de forêt et d’ombre, en accordant peu d’attention aux herbes “sauvages” ou cultivés en plantation.
Parmi les porteurs signalés du champignon du chancre noir, on trouve : S. alba (saule blanc) ; S. amygdaloides (saule à feuilles de pêcher) ; S. aurita (saule à oreilles) ; S. babylonica (saule pleureur) S. bebbiana (saule Bebb) ; S. caprea (saule à chèvre) ; S. discolor (saule à chatte) ; S. eriocephala (saule du Missouri) ; S. fragilis (saule à fentes) ; S. lucida (saule brillant) ; S. nigra (saule noir) ; et, S. sericea (saule soyeux). Les saules de laurier (S. pentandra) et d’osier violet (S. purpurea) sont considérés comme résistants au champignon du chancre noir.
Le saule pleureur (S. babylonica) serait également résistant à l’infection ; cependant, la brûlure du saule pleureur est devenue problématique dans de nombreuses régions de l’Oregon, de l’État de Washington et du sud de la Colombie-Britannique. Dans les plantations de saules de l’État de New York, l’apparition du chancre noir semble être rare et n’a été trouvée qu’en affectant des hybrides de S. viminalis et S. miyabeana.
Signes et symptômes
Les symptômes du chancre noir apparaissent d’abord sur les feuilles à la fin du printemps et au début de l’été (avril-juin) sous forme de lésions brunes à noires au contour irrégulier. Les feuilles infectées se ratatinent généralement et meurent lorsque le champignon se développe rapidement allant du limbe passant par le pétiole, pour finir dans le rameau.
Chaque invasion du rameau entraîne la formation d’un chancre de taille variable en fonction de la résistance relative du porteur. Les plantes résistantes sont rarement infectées, mais lorsque l’infection se produit, un chancre discret (longueur : 1-3 cm) se forme souvent à la jonction entre le rameau et le pétiole. En revanche, de grands chancres (longueur : 5-8 cm) sont produits sur les rameaux des saules sensibles. Les chancres peuvent rester localisés au point d’infection ou s’étendre et encercler le rameau. L’extrémité des rameaux ceinturés présente souvent un affaissement ou un crochet visible dû au flétrissement et la mort des tissus aux extrémités distals du chancre. Les chancres enfoncés qui sont dû à la nécrose des tissus de l’écorce sont très vite recouverte de fructifications érumpentes en forme de soucoupe (acervules) ayant des spores asexuées (conidies).
En culture, les conidies de G. miyabeana sont unicellulaires, 12-24 μm x 3-6 μm, et incolores (hyalines). Cependant, les conidies exsudées des acervules paraissent roses en masse. Les fructifications sexuelles (périthèces) se développent à l’automne (fin août-octobre) dans les chancres qui contiennent ou ont déjà produit des acervules. Les périthèces sont sous-globulaires, 140-200 μm de large, et portent des sacs à parois fines (asci) qui contiennent des ascospores unicellulaires hyalines.
Cycle de maladie
Les conidies et/ou les ascospores produites sur les rameaux infectés l’année précédente provoquent des infections primaires au printemps. Cependant, la propagation et l’intensification de la maladie sont causées par des cycles répétés d’infection par les conidies.
Durant les climats chauds et humides, les conidies suintent partant des acervules et se propagent par les éclaboussures de pluie et, éventuellement, par les insectes. La progression de la maladie augmente avec la création de nouveaux chancres et de cycles secondaires de conidies tout au long de l’été et de l’automne.
Dommages
Comme indiqué précédemment, G. miyabeana en tant que pathogène primaire s’avère être rare dans les plantations de saules et peu d’informations sont actuellement disponibles concernant les dommages qu’il peut causer sur les arbustes commerciaux de saules.
Cependant, il est possible de voir une augmentation du chancre noir à mesure que des plantations à grande échelle s’établissent. L’agent pathogène pourrait provoquer une défoliation, un dépérissement important et un retard de croissance si plusieurs cycles d’infection répétés se produisent au cours d’une ou deux saisons de croissance.
Shawn C. Kenaley1, George W. Hudler1, Dawn Dailey O’Brien1, Kimberly D. Cameron2, et Lawrence B. Smart2,*
- Département de pathologie végétale et de biologie des plantes et des microbes, Université de Cornell, Ithaca, NY
- Département de l’horticulture, Université de Cornell, Station d’expérimentation agricole de l’État de New York, Genève, NY
Financement fourni par le New York Farm Viability Institute à LB Smart.
Références sélectionnées
Brooks, F. T., et M. M. Walker. 1935. Observations sur le Fasicladium saliciperdum. New Phytologist 34:64-67. Clinton, G. P. et F. A. McCormick. 1929. Le champignon de la tavelure du saule : Fusicladium saliciperdum. de Connecticut Bulletin no. 302. Station d’expérimentation agricole de Connecticut, New Haven, CT. 26 pp plus les planches. Hill, J. T., D. H. Ormrod, et R. J. Copeman. 1977. La brûlure du saule pleureur sur la côte de la Colombie-Britannique. Enquête canadienne sur les maladies des plantes 57 : 71-74. Horst, R. K. 2001. Manuel sur les maladies de Westcott. 6e édition, Kluwer Academic Publishers. Norwell, MA, USA. pp 902. Rupert, J. A. et J. G. Leach. Brulures de saule en Virginie de l’Ouest. Phytopathologie 32:1095-1096.


Le Chancre Leucostoma
Introduction
Le Leucostoma niveum, un champignon, provoque un chancre et un dépérissement sur le tremble (Populus spp.) et sur le saule (Salix spp.) ainsi que sur plusieurs autres espèces d’arbres et d’arbustes feuillus. Les hôtes sensibles de ce pathogène sont souvent stressés par la compétition avec la végétation voisine, la sécheresse, les manque d’alimentation, les blessures hivernales et/ou les blessures. Par conséquent, L. niveum (ci-après dénommé Leucostoma) est considéré comme un agent pathogène opportuniste, capable de coloniser des tiges ou des rameaux blessés ou affaiblis par d’autres causes.
Signes et symptômes
Les chancres de Leucostoma sont creux, de couleur jaune-brun ou noire, et de forme allongée (ellipsoïde) ou irrégulière sur les branches, les tiges ou les rameaux. La marge de chaque chancre de tige est bien defini par une petite crête (c’est-à-dire une lèvre ou un rouleau) de tissu calleux qui entoure l’écorce foncée du chancre.
De petites pustules blanches (diamètre : 1-2 mm) portant des fructifications asexuées (pycnides) et/ou sexuelles (périthèces) se développent dans le tissu d’écorce nécrosé, et le contexte blanc de l’un ou l’autre type de fructification est facilement visible lorsqu’on le coupe avec une lame tranchante. On peut trouver plusieurs générations de pycnides ainsi que des périthèces dans un seul chancre.
Toutefois, les pycnides sont les premiers organes de fructifications à développer après l’infection et apparaissent généralement au printemps ou à l’été suivant l’infection. Plus tard dans la saison de croissance, les périthèces accompagnent souvent les pycnides dans des pustules individuelles et ils deviennent matures en automne et en hiver.
Après un temps humide, des vrilles de spores asexuées (cornes conidiennes ; cirrhi) sont exsudées à travers les minuscules pores des pycnides et peuvent “pousser” jusqu’à plusieurs millimètres au-dessus de la surface du chancre avant de s’effondrer en une masse gluante lors de la prochaine pluie. Les conidies sont incolores, unicellulaires, quelque peu courbées (en forme de saucisse), et d’environ 4-6 x 0,8 µm. Les périthèces sont noirs, en forme de flask, et mesurent de 0,3 à 0,5 mm (généralement 0,5 mm) de diamètre à maturité, et sont disposés en cercle (anneau) à l’intérieur du stroma sexuel (pustule ; 6-18 périthèces/anneau). Les spores sexuelles portées dans le périthèce (ascospores) sont contenues dans des “sacs” en forme de club (asques ; 8 ascospores/ascus). Les ascospores sont hyalines, en forme de saucisse comme les conidies, mais environ deux fois plus grandes, mesurant généralement 8,0 x 1,3 µm.
Cycle de maladie
Le leucostome hiverne sous forme de mycélium dans les rameaux, bourgeons ou tiges infectés. Les conidies sont produites tout au long de la saison de croissance dans des pycnides encastrées dans les parties infectées de la plante. Pendant et peu après la pluie, les conidies sont dispersées par le vent, les éclaboussures de pluie ou les insectes, et sont à l’origine de la majorité des infections.
Les ouvertures naturelles (par exemple, les bourgeons et les lenticelles) et les blessures créées par l’homme, les blessures abiotiques ou les dégâts causés par les insectes semblent être les sites d’infection les plus fréquents, probablement parce que ce pathogène ne peut pas pénétrer l’écorce intacte du saule. Les infections des conidies peuvent se produire tout au long de la saison de croissance, en particulier au printemps et à la fin de l’automne, et surtout si les arbustes sont stressés par des conditions environnementales ou culturales défavorables.
Les chancres de Leucostoma se développent lorsque l’hôte est en dormance, mais lorsque les températures sont suffisamment élevées pour permettre la croissance du champignon. Cependant, pendant la saison de croissance, les saules réagissent aux blessures de toutes sortes - y compris celles causées par l’invasion d’agents pathogènes - par la production de bois blessé ou de cals. Des chancres provoqués par les ascospores se produisent probablement ; mais le rôle des ascospores dans l’épidémiologie de la maladie de Leucostoma nest toujours pas clair.
Dommages
Bien que les agents pathogènes du chancre soient à l’origine de certaines des maladies les plus destructrices des arbres forestiers (par exemple, la brûlure du châtaignier, la maladie de l’écorce du hêtre, le chancre de Scleroderris), il n’existe actuellement aucune preuve indiquant que le chancre de Leucostoma est une menace pour les saules cultivés dans les plantations à courte rotation dans l’État de New York. Il est maintenant probable que le Leucostoma sur les saules plantés soit le signe d’un stress nutritif ou hydrique, de dommages causés par les insectes ou de dommages dus au gel et au dégel.
Références sélectionnées
Kern, H. 1955. Études taxonomiques dans le genre Leucostoma. Documents de l’Académie des sciences du Michigan. 40:9-22. Markovic, M., D. Karadzic, V. Lazarev, P. Pap, et L. Poljakovic-Pajnik. 2007. Complexe Mycologique sur les feuilles et l’ecorce de l’espece Salix dans le Bassin central de Danube. Acta Silvatica et Lignaria Hungarica, édition spéciale, pp 75-80. Schreiner, E. J. 1931. Deux espèces de Valsa causant des maladies chez les populus. Revue Américaine Botanique 18:1-29. Sinclair, W. A. et H. H. Lyon. 2005. Maladies des arbres et des arbustes. 2e édition, Presse Universitaire de Cornell. Ithaca, NY, USA. pp 172.Spielman, L. J. 1985. Une monographie de Valsa sur les feuillus en Amérique du Nord. Revue Canadienne Botanique 63:1355-1378.. Shawn C. Kenaley1, George W. Hudler1, Dawn Dailey O’Brien1, Kimberly D. Cameron2, et Lawrence B. Smart2,* Département de pathologie végétale et de biologie des plantes et des microbes, Université de Cornell, Ithaca, NY Département de l’horticulture, Université de Cornell, Station d’expérimentation agricole de l’État de New York, Genève, NY Financement fourni par le New York Farm Viability Institute à LB Smart..

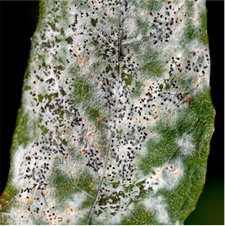
La Rouille Des Feuilles
Introduction
La rouille des feuilles du saule (Salix spp.), une maladie répandue et commune des Salix indigènes et cultivés, peut grandement défolier les arbustes et/ou les arbres, jusqu’à 100 % des feuilles tombant six semaines ou plus avant la chute normale des feuilles en automne. La maladie est causée par des champignons appartenant au genre Melampsora (Uredinales : Melampsoraceae) et est considérée comme la maladie la plus récurrente qui touche les plantations de saules gérées de manière intensive en Amérique du Nord ainsi qu’en Europe.
La rouille des feuilles du saule (Salix spp.), une maladie répandue et commune des Salix indigènes et cultivés, peut gravement défolier les arbustes et/ou les arbres, jusqu’à 100 % des feuilles tombant six semaines ou plus avant la chute normale des feuilles en automne. La maladie est causée par des champignons appartenant au genre Melampsora (Uredinales : Melampsoraceae) et est considérée comme la maladie la plus grave qui touche les plantations de saules gérées de manière intensive en Amérique du Nord ainsi qu’en Europe.
Science
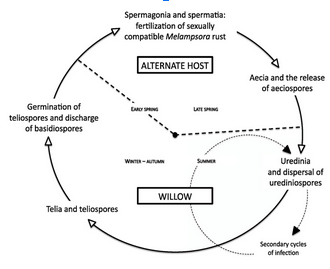
Les espèces de Melampsora qui infectent les saules ont des histoires de vie complexes au cours desquelles elles alternent entre le saule et un hôte non apparenté pour compléter leur cycle de vie. Deux espèces, M. epitea et M. paradoxa, existent en Amérique du Nord.
Les hôtes alternatifs importants de M. epitea dans l’État de New York sont le sapin baumier, le sapin blanc et les saxifrages. Melampsora paradoxa infecte le saule ainsi que le mélèze d’Europe, le mélèze de l’Ouest et le mélèze laricin. Des pustules de couleur jaunes ou orange (urédinies) apparaissent sur la face inférieure des feuilles de saule dès la fin du printemps et se poursuivent tout au long de l’été.
Ces pustules finissent par rompre l’épiderme pour libérer un grand nombre de spores jaune doré (urédospores). Cette étape du cycle de vie de la rouille, appelée “phase de répétition”, sert à réinfecter continuellement l’hôte Salix initial ainsi qu’à propager la rouille aux saules environnants. Au mi- automne, les urédospores se transforment en télies brun orangé ou brun foncé qui passent l’hiver sur les feuilles de saule tombées et libèrent des basidiospores fragiles au printemps suivant.
Les basidiospores sont transportées par le vent et elles infectent le feuillage de l’hôte a proximité (par exemple, le sapin baumier). Les spermogonies apparaissent peu après l’infection à la fin du printemps et sont suivies par des écidiospores contenant des écidiospores de couleur jaunes ou orange, qui sont dispersées par le vent et pertubent la croissance actuelle du saule.
En deux semaines, des urédines et des urédiniospores sont produites à la surface inférieure des feuilles de saule, renouvelant ainsi le cycle de vie du champignon. Des preuves concrètes existent qui démontrent que des formes spéciales de Melampsora spp. peuvent passer l’hiver sous forme de mycélium ou d’urédinies dans les bourgeons et les tiges de saule en dormance. Dans ce cas, cela élimine le besoin d’un hôte alternatif et raccourcit le cycle annuel de la maladie.
Susceptibilité
De infestations récurrentes de saules par le Melampsora spp. peuvent entraîner une défoliation, une sénescence prématurée des feuilles et prédisposer les arbres hôtes à des facteurs de stress abiotiques (par exemple, concurrence et sécheresse) ainsi qu’à des organismes pathogènes secondaires (par exemple, agents pathogènes foliaires et/ou chancres).
Ensemble, ces facteurs peuvent conduire à des réductions considérables de la biomasse. La sensibilité des espèces indigènes de Salix (par exemple, S. discolor, S. eriocephala, S. nigra, S. pyrifolia) à l’infection par Melampsora n’a pas été élucidée et justifie une étude future, cependant, on pense que tous les saules endémiques des régions tempérées fraîches d’Amérique du Nord sont sensibles à au moins une espèce du Melampsora.
Dans les plantations productrices de biomasse à New York, la majorité des S. eriocephala semblent être très sensibles à la rouille Melampsora. Plusieurs cultivars de S. purpurea ainsi que des croisements entre S. viminalis et S. miyabeana sont également sensibles à l’infection ; cependant, les infections foliaires sur ces clones sont limitées au tiers inférieur de la canopée et la défoliation associée à la rouille est rare. Plus de recherches et d’études d’inoculation sont nécessaires pour mesurer la résistance à la rouille chez les clones et génotypes de saule.
Gestion
Des réductions considérables de rendement peuvent être évitées en plantant des mélanges de clones de saule qui diffèrent par leur résistance à la rouille Melampsora. Six à dix génotypes sont couramment plantés dans les taillis européens où la pression des maladies est élevée. Les fongicides (par exemple, le triadiméfon ou le mancozèbe) sont également efficaces pour protéger le saule contre la rouille.
Toutefois, les applications régulières de fongicides sont nocives sur le plan économique et environnemental. Une bonne couverture chimique pour le contrôle de la rouille est encore compliquée 1 à 3 ans après le taillis par la densité des selles/tiges et le mélange des feuillages. Par conséquent, l’application de fongicides n’est pas une méthode privilégiée pour lutter contre la rouille dans les plantations de taillis à courte rotation.
Références sélectionnées
Horst, R. K. 2001. Westcott’s disease handbook. 6th edition, Kluwer Academic Publishers. Norwell, MA, USA. pp 901. Sinclair, W. A. and H. H. Lyon. 2005. Diseases of Trees and Shrubs. 2nd edition, Cornell University Press. Ithaca, NY, USA. pp 8-10. Shawn C. Kenaley1, George W. Hudler1, Dawn Dailey O’Brien1, Kimberly D. Cameron2, and Lawrence B. Smart2,* Department of Plant Pathology and Plant-Microbe Biology, Cornell University, Ithaca, NY Department of Horticulture, Cornell University, New York State Agricultural Experiment Station, Geneva, NY Funding provided by New York Farm Viability Institute to LB Smart.


L’Oïdium
Introduction
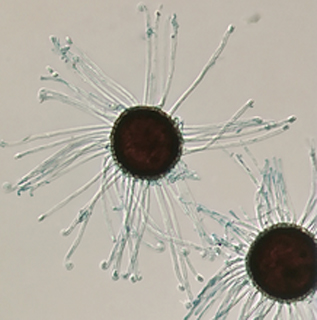
L’oïdium est un champignon phytopathogène qui ne peut se développer et se reproduire que sur le tissu vivant de l’hôte. La grande partie du corps d’un champignon d’oïdium reste en dehors des cellules hôtes et est facilement visible sur les feuilles infectées. Le parasitisme se fait par le biais d’un organe spécialisé (haustorium) qui siphonne les nutriments des cellules épidermiques sans blesser la plante. Les saules (Salix spp.) sont sensibles à deux oïdium : l’Erysiphe adunca et le Phyllactinia guttata.
Hôtes and distribution
L’érysiphe adunca apparait généralement sur le tremble et sur le cotonnier (Populus spp.) ainsi que sur les saules dans les régions tempérées de l’hémisphère nord. Le Phyllactinia guttata est également largement répandu en Amérique du Nord et on a signalé qu’il infecte plus de 38 espèces de plantes ligneuses, dont le tremble/cotonnier et le saule, ainsi que l’orme, l’aubépine, l’érable, le chêne, l’amélanchier et le sycomore.
Signes et symptômes
Les signes et les symptômes apparaissent généralement à la fin de l’été (août) ou au début de l’automne (septembre). Les mycéliums d’E. adunca et du P. guttata se présentent sous la forme de taches blanches floues qui ensemble produisent un revêtement continu sur les feuilles touchées.
Chaque champignon produit des quantités massives de spores asexuées et sexuelles, et les deux espèces sont facilement différenciées après examen microscopique des fructifications (cléistothèces) dans lesquelles les spores sexuelles sont portées.
Les cléistothèces d’E. adunca sont brun foncé, sphériques, et ont des appendices minces et filiformes. Phyllactinia guttata produit également des cleistothèques brun foncé, mais elles ont des appendices en forme d’aiguilles.
Cycle de maladie
L’oïdium se propage par les spores produites à la surface des feuilles infectées. Les conidies sont produites tout au long de la saison de croissance, particulièrement au début de l’automne, et elles sont dispersées sur de courtes distances par le vent vers d’autres parties de la même plante ou vers des hôtes a proximité.
Les fructifications sexuelles apparaissent en automne sous la forme de minuscules sphères brunes ou noires à l’intérieur des tapis blancs du champignon et elles jouent le rôle de structures d’hivernage. Au printemps, les spores sexuelles (ascospores) sont expulsées de la cléistothèque dans l’air et transportées par le vent vers des hôtes sensibles.
Les ascospores et les conidies sont tout aussi efficaces pour provoquer l’infection. Lorsque l’une ou l’autre spore se dépose sur une feuille, elle germe pour produire un tube germinatif primaire et des hyphes radiaux qui explorent la surface de la feuille.
Peu de temps après, des gonflements se développent sur les hyphes individuels, ce qui fixent le jeune champignon à la surface de la feuille. L’infection est initiée par la pénétration mécanique de la cuticule de la feuille par les tubes de pénétration et le parasitisme est établi par la croissance intercellulaire de l’haustoria dans les cellules épidermiques de la feuille.
Dommage
Vu que les oïdiums siphonnent les nutriments de la plante, ils provoquent souvent un déclin général de la croissance et de la vigueur, une défoliation prématurée ou un rabougrissement. Plusieurs années consécutives d’infection récurrente peuvent entraîner une perte considerable de croissance et exposer les arbustes de saules aux pathogènes et/ou ravageurs secondaires.
Références sélectionnées
Bagyanarayana, G. 2005. L’espèce de Melampsora sur Salix (Salicaceae). M. H. Pei et A. R. McCracken, eds. Les maladies de la rouille de l’oïdium et du peuplier. CAB International ; Cambridge, MA, USA, pp. 29-50. Extension Coopérative de l’Université de Cornell. 2007. 2008 Guide de lutte contre les ravageurs pour la production commerciale et l’entretien des arbres et arbustes. Université de Cornell ; Ithaca, NY, USA. pp.107. Johnson, W. T., W. A. Sinclair et J. L. Saunders. 1976. Insectes et maladies du saule et du peuplier. Université de Cornell ; Ithaca, NY, USA. pp. 7. McCracken, A. R., et W. M. Dawson. 2003. Maladie de l’oïdium (Melampsora epitea) du saule (Salix spp.) cultivé sous forme de taillis à rotation courte (SRC) dans des mélanges inter- et intra-espèces. Ann. Appl. biol. 143:381-393 Shawn C. Kenaley1 , George W. Hudler1 , Dawn Dailey O’Brien1 , Kimberly D. Cameron2 , et Lawrence B. Smart2,* Département de pathologie végétale et de biologie des plantes et des microbes, Université de Cornell, Ithaca, NY 14853 Département de l’horticulture, Université de Cornell, Station d’expérimentation agricole de l’État de New York, Genève, NY 14456. Financement fourni par le New York Farm Viability Institute à LB Smart.


Les chrysomèles du saule
Introduction
Les chrysomèles (les coléoptères de la famille Chrysomelidae) sont les principaux ravageurs des saules arbustifs aux États-Unis et en Europe. Deux espèces, Calligrapha multipunctata, ou encore le coléoptère indigène du saule, et Plagiodera versicolora Laicharting ou encore le coléoptère importé du saule, sont communément trouvées sur les saules arbustifs tout au long de la saison de croissance aux États-Unis et sont considérées comme des “spécialistes”, se nourrissant presque exclusivement de saules.
Les larves et les adultes se nourrissent des feuilles de saule, soit en squelettant la feuille (larves), soit en la dévorant, créant ainsi de multiples petits trous dans les feuilles (adultes). Bien que les dommages causés aux feuilles par les coléoptères tuent rarement une plante, ils peuvent entraîner une réduction du rendement et de la sensibilité à d’autres parasites et maladies.
Science
Dans le nord-est des États-Unis, les saules importés et indigènes sont des mangeurs de feuilles.
Susceptibilité
Les chrysomèles se nourrissent de principalement d’espèces particulières de saules arbustifs, notamment les espèces indigènes S. eriocephala, S. bebbiana et S. discolor. Elles se nourissent rarement de l’espèce naturalisée S. purpurea et d’autres variétés commerciales, telles que S. miyabeana ‘SX64’ ou ‘SX67’, S. sachalinensis ‘SX61’, S. purpurea x S. miyabeana ‘Oneida’ et S. sachalinensis x S. miyabeana ‘Sherburne’ ou ‘Canastota’.
Les saules produisent une série de composés chimiques pour protéger leurs nouvelles feuilles des attaques de coléoptères. Certaines espèces tolèrent les attaques par les chrysomèles, compensant les feuilles endommagées en produisant de nouvelles pousses et de nouvelles feuilles.
Selon l’étendue et la durée des attaques en saison, les saules peuvent devenir plus sensibles aux stress environnementaux, tels que la sécheresse, ou à d’autres parasites et maladies. Une attention particulière doit être accordée aux plantations pendant leur année d’établissement, lorsque les dommages causés aux feuilles des jeunes plantes peuvent entraîner un mauvais établissement avec une plus grande sensibilité à d’autres problèmes environnementaux.
Gestion
L’effets de défoliation par les larves et les chrysomèles adultes sur le rendement n’ont pas encore été quantifiés aux États-Unis, mais d’après les données recueillies en Suède, une défoliation importante entraîne une réduction significative du rendement tout au long du premier cycle de récolte (Björkman et al., 2000). Il a été démontré que la défoliation due aux attaques de coléoptères sur le coton réduisait la croissance pendant plusieurs années chez le Populus (Coyle et al., 2008), et d’autres études ont suggéré que des réductions similaires de la croissance sont possibles dans les plantations de saules (Kendall et Wiltshire, 1998).
En Suède, une étude a montré que la cultivation de saules en monoculture augmentait le risque d’épidémies de ravageurs (Dalin et al., 2009), raison pour laquelle la cultivation d’un mélange de variétés dans de multiples groupes de diversité peut être bénéfique. Toutefois, des recherches supplémentaires sont nécessaires pour évaluer pleinement cette stratégie pour l’Amérique du Nord.
À l’heure actuelle, aucune mesure préventive contre les chrysomèles n’est disponible dans les cultivations de saules à courte rotation. Des pesticides conventionnels tels que le carbaryl (Sevin) et le spinosad (Conserve) sont efficaces et élaborées pour une utilisation sur les arbustes ornementaux, mais aucun n’est prévue pour les cultures bioénergétiques de saules. Votre expert local en vulgarisation coopérative peut vous fournir de plus amples informations sur les mesures de lutte spécifiques à votre région.
Si jamais les Chrysomèles du saule décidaient d’élire domicile sur les branches de vos saules
Commandez ce produit sur Amazon
Au fil des années, notre clientèle à parfois fait appel à notre expertise afin de valider si des Chrysomèles du saule pouvaient êtres responsables des dommages causés à leur plantation. Ainsi, si jamais des intrus de ce type en venaient à élire domicile sur les branches de vos saules simplement utiliser ce produit que vous pouvez commander directement en ligne et qui sera livré en quelques jours chez vous pour remédier à la situation disons désagréable et pénible pour vos saules.
Ce savon vous permettra de redonner toute la liberté à vos saules et ainsi les protéger de ce fléau qui risque de les affecter négativement et ce de façon permanente. Il existe en format 1L ou en format de recharge de 500 ml. Ceux-ci peuvent être commandés directement sur Amazon et vous seront livrés rapidement directement à votre porte
Références sélectionnées
Björkman, Cetal. (2000) Agric. For. Entomol. 2: 131-139. Coyle, D, et al. (2008) Forest Ecol. Manag. 255:3365-3373. Dalin, P, et al. (2009) PLoS ONE 4: Article No.: e5487. Kendall, D et C Wiltshire (1998) Eur. J. Forest Pathol. 28: 281-288. Kimberly D. Cameron1, Gregory M. Loeb2, Lawrence P. Abrahamson3, Cullen White1, et Lawrence B. Smart1* Dept. D’ Horticulture, 2Dept. D’Entomologie, Université de Cornell, Station d’expérimentation agricole de l’État de New York, Geneva, NY Financement fourni par le New York Farm Viability Institute à LB Smart.




Les Coléoptères Japonais
Introduction
Le coléoptère japonais, Popillia japonica Newman, est un parasite récurrent pour plus de 250 plantes ornementales, légumes, arbres et arbustes différents, y compris de nombreuses variétés de saules arbustifs.
Originaire du Japon, cette espèce envahissante était vu pour la premiere fois dans l’est des États-Unis en 1916 et continue de causer des dégâts importants dans tout le nord-est des États-Unis. En 1998, le Cléopâtre japonais apparaissait dans tous les États à l’est du Mississippi, à l’exception de la Floride, ainsi que dans de nombreuses régions du Midwest.
Pendant les mois d’été, les formes adultes se nourrissent de diverses espèces de plantes, ne laissant derrière rien qu’un réseau de nervures foliaires. Les mélanges de substances volatiles végétales libérées par les feuilles endommagées par les coléoptères attirent fortement d’autres adultes produisant de très grandes populations localisées de coléoptères.
Pendant l’été, les femelles adultes pondent des œufs dans le gazon voisin et les jeunes vers blancs passent l’automne et le printemps à se nourrir de racines. Pour gérer les infestations de coléoptère japonais, il faut contrôler à la fois les stades adultes et les vers blancs. L’élevage de nouvelles variétés de saules arbustifs résistants aux attaques du coléoptère japonais contribuera à réduire les dégâts qu’ils causent.
Science
Les formes adultes du coléoptère japonais sont ovales ayant six touffes de poils blancs de chaque côté du corps, avec des ailes vertes métalliques de couleur bronze, et mesurent environ 12 mm de long. La femelle adulte pond 40 à 60 œufs sur plusieurs semaines, légèrement sous la surface du sol, généralement proche de l’endroit où elle se nourrit. Les œufs éclosent en quelques semaines en petits vers blancs crème, en forme de C, d’environ 24 mm de long à maturité.
Les vers blancs se nourrissent de racines de diverses herbes, de mauvaises herbes et de cultures de pépinière jusqu’à ce que la température se refroidisse à la fin de l’été et au début de l’automne. Les vers blancs immatures s’enfouissent alors de 50 à 100 mm sous terre pour passer l’hiver.
Au début du printemps, les vers blancs redeviennent actifs et se nourrissent des racines jusqu’à la nymphose. Les nymphes éclosent et sortent du sol en fin juin et commencent immédiatement à se nourrir sur la surface supérieure des feuilles d’un certain nombre d’espèces de plantes différentes.
Les volatiles libérés par les feuilles endommagées par les coléoptère japonais (Loughrin et al, 1995, 1997) et une forte phéromone d’agrégation émise par les femelles non accouplées (Ladd, 1970) attirent d’autres scarabées vers une source de nourriture potentielle. Par temps clair, chaud et humide, les coléoptères prennent leurs envole et vont vers de nouvelles plantes hôtes.
Susceptibilité
Les adultes du coléoptère japonais se nourrissent de la face supérieure des feuilles en mangeant entre les nervures produisant ainsi des feuilles squelettisées. Généralement, ils se nourrissent commençant par le sommet de la plante, puis les coléoptères se déplacent vers le bas de la plante à mesure que en se nourissant.
La période idéale de nutrition va du milieu de la matinée jusqu’à la fin de l’après-midi ; ils se nourrissent aussi rarement en soirée et pendant la nuit (Kreuger et Potter, 2001). Le coléoptère japonais se nourrit préférentiellement des variétés de saules arbustifs précis, ciblant surtout les variétés de Salix eriocephala (y compris ‘S25’) et de S. x dasyclados ‘SV1’, et ciblant moins les variétés de S. purpurea, telles que ‘Fish Creek’, ‘Allegany’ et ‘Onondaga’.
Les populations de coléoptères japonais adultes se développent rapidement et peuvent causer des dommages considérables au feuillage, mais les effets à long terme sur le rendement n’ont pas été déterminé. Les vers blancs causent des dommages importants aux racines des gazons et des études ont montré que les vers blancs ont une préférence pour le ray-grass vivace (Crutchfield et Potter, 1994). On ne pense pas que les racines des saules arbustifs soient endommagées par l’alimentation des vers blancs.
Gestion
La gestion du coléoptère japonais doit comprendre la gestion de l’adulte et celle de la larve. Alors que les coléoptères adultes sont attirés par les plantes volatiles, l’efficacité des pièges appâtés avec des phéromones et des plantes volatiles est très controversée. Dans de nombreuses études, les pièges n’ont pas empêché ou réduit les dommages aux plantes ni réduit la densité des larves dans le sol (Gorden et Potter, 1985). Les pièges sont plus utiles pour surveiller les nouvelles infestations de coléoptères japonais.
Les pulvérisations d’insecticides, tels que les produits à base de pyréthroïde et de carbaryl, sont souvent utilisées pour contrôler les populations de scarabées japonais adultes, mais elles n’offrent qu’une protection temporaire.
Bien que le savon insecticide pulvérisé directement sur les coléoptères adultes les tue efficacement, il n’offre aucune protection résiduelle benefique. L’évaluation des populations de larves dans des échantillons de sol ou de racines peut aider à déterminer s’il est nécessaire de les gérer avec des insecticides. Si c’est le cas, des insecticides tels que l’imidaclopride et l’halofenozide sont homologués pour lutter contre les vers blancs dans le gazon et doivent être appliqués à titre préventif en été, après le début de la ponte.
Combattre les vers blancs au printemps avec de l’insecticide n’est ni efficace ni recommandée. Les variétés de saules sensibles ne doivent pas être plantées à proximité de grandes surfaces de gazon, comme les terrains de golf. La gestion durable des adultes et des vers blancs des coléoptères japonais ne se fera probablement qu’avec le développement de plantes hôtes résistantes.
Un des objectifs du programme de sélection de saules de New York est d’identifier de nouvelles variétés de saules arbustifs résistants au coléoptère japonais.
Si jamais les Coléoptère japonais, décidaient d’élire domicile sur les branches de vos saules
Commandez ce produit sur Amazon
Au fil des années, notre clientèle à parfois fait appel à notre expertise afin de valider si des Coléoptère japonais, pouvaient êtres responsables des dommages causés à leur plantation. Ainsi, si jamais des intrus de ce type en venaient à élire domicile sur les branches de vos saules simplement utiliser ce produit que vous pouvez commander directement en ligne et qui sera livré en quelques jours chez vous pour remédier à la situation disons désagréable et pénible pour vos saules.
Ce savon vous permettra de redonner toute la liberté à vos saules et ainsi les protéger de ce fléau qui risque de les affecter négativement et ce de façon permanente. Il existe en format 1L ou en format de recharge de 500 ml.
Références sélectionnées
Crutchfield, BA et DA Potter, 1994. J. Entomol. Sci. 29:398-406. Gorden, FC et DA Potter, 1985. J. Econ. Entomol. 78:774-78. Kreuger, B et DA Potter, 2001. Environ. Entomol. 30:172-80. Ladd, TL Jr. 1970. J. Econ. Entomol. 63:905-8. Loughrin, JH, et al. 1995. J. Chem. Ecol. 21:1457-67. Loughrin, JH, et al. 1997. Environ. Entomol. 26:334-42. Kimberly D. Cameron1, Gregory Loeb2, Lawrence P. Abrahamson3, Cullen White1, et Lawrence B. Smart1* Département des sciences horticoles, 2 Département d’entomologie, Université de Cornell, Station d’expérimentation agricole de l’État de New York, Genève, NY
SUNY Collège de Sciences Environnementales & Forestières, Syracuse, NY
Financement fourni par le New York Farm Viability Institute à LB Smart..




La cicadelle de la pomme de terre
Introduction
La cicadelle de la pomme de terre, Empoasca fabae Harris, est un parasite recurrent de certaines variétés de saules arbustifs (Salix spp.) dans l’est et le centre-ouest des États-Unis et dans certaines parties de l’est du Canada. Elle est le principal insecte nuisible de la luzerne et peut affecter certains légumes, arbres fruitiers et vignes.
Les adultes et les nymphes se nourrissent de certaines variétés de saules arbustifs, extrayant la sève des feuilles et provoquant une réduction de la croissance internodale, un enroulement des feuilles, une chlorose et une chute précoce des feuilles. Les dégâts peuvent être graves et entraîner une réduction substantielle du rendement.
Science
La cicadelle adulte de la pomme de terre mesure environ 3 mm de long, elle est cunéiforme, ailée et de couleur verte clair. La nymphe est sans ailes et plus petite que l’adulte, mais sa forme et sa couleur sont similaires.
Lorsqu’elles sont perturbées, les adultes sautent facilement ou s’envole, tandis que les nymphes peuvent être observées sur la face inférieure des feuilles, se déplaçant généralement de côté. Les nymphes deviennent des adultes en 14-17 jours environ. Les femelles matures, dont la durée de vie est d’environ 30 jours, pondent 2 à 3 œufs par jour dans les tiges et les nervures des feuilles. Les œufs mesurent environ 1 mm de long, sont allongés et blancs, et éclosent en 7-10 jours.
Ce cycle de vie se poursuit jusqu’à la fin de l’été, lorsque le froid tue tous les stades de vie. Les adultes ne tolèrent pas les conditions de gel et passent l’hiver dans les États du sud. Au printemps, ils se déplacent vers le nord et l’ouest grâce aux vents thermiques qui arrivent dans le nord des États-Unis à partir du mois de mai. En été, la cicadelle de la pomme de terre se répartit de la côte atlantique aux montagnes Rocheuses et jusqu’au sud du Canada.
Susceptibilité
Les cicadelles de la pomme de terre sont des insectes suceurs qui extraient la sève de la plante directement des nervures de la face inférieure de la feuille, des pétioles et parfois des jeunes tiges.
Au cours du processus d’extraction, ils injectent également une toxine qui endommage la plante. Le double effet de l’alimentation et de la toxine provoque un retard de croissance, un enroulement des feuilles et un ensemble de symptômes connus sous le nom de “brûlure de la trémie”.
La brûlure de la trémie se caractérise par un blanchissement des nervures, suivi d’un jaunissement rapide des feuilles, puis de leur brunissement et de leur mort. L’enroulement des feuilles est le symptôme le plus évident et s’accompagne généralement d’une réduction de la croissance internodale, qui peut aller de légère à grave. Une brûlure de trémie grave peut freiner la croissance significantly, réduisant considérablement les rendements et affaiblissant la plante pour les dommages causés par d’autres organismes ou par des stress environnementaux tels que la sécheresse.
Les variétés de saules arbustifs développées en Europe, basées sur des pedigrees avec Salix viminalis ou S. viminalis x S. schwerinii, sont très sensibles à la cicadelle de la pomme de terre. Les hybrides de S. viminalis développés dans le cadre du programme de sélection de New York présentent une gamme de sensibilité à la cicadelle de la pomme de terre.
Les variétés très sensibles présentent un rabougrissement important et des brûlures de trémie lorsqu’elles sont plantées dans des zones où la cicadelle de la pomme de terre est abondante. Les variétés plus résistantes peuvent présenter l’enroulement foliaire typique de la brûlure de la trémie avec une réduction de croissance internodale mineure ou nulle.
Gestion
Les populations de cicadelles de la pomme de terre peuvent se développer rapidement tout au long de l’été en fonction de l’heure d’arrivée, de la disponibilité des hôtes et de la température. Dans des conditions météorologiques idéales, jusqu’à six générations peuvent se succéder pendant les mois d’été, créant ainsi d’importantes populations locales de cicadelles de la pomme de terre.
Les saules arbustifs proches de la luzerne peuvent facilement être atteints par les problèmes de cicadelles de la pomme de terre. Les fortes pluies peuvent déloger les nymphes des plantes et réduire temporairement leur impact, et les tempêtes venant du sud peuvent transporter un influx de cicadelles de la pomme de terre dans une région augmentant leur impact.
Bien que la cicadelle de la pomme de terre soit attaquée par plusieurs prédateurs, parasites et champignons pathogènes, une lutte efficace peut nécessiter l’utilisation de pesticides.
Aucune pratique de gestion recommandée n’est actuellement disponible, bien que la cicadelle de la luzerne puisse être prévenu avec des insecticides chimiques. La plantation de plusieurs variétés de saules arbustifs est bonne, tout comme la plantation de variétés plus résistantes dans les zones fortement touchées par la cicadelle de la pomme de terre.
Références sélectionnées
Kimberly D. Cameron1, Gregory M. Loeb2, Lawrence P. Abrahamson3, Cullen White1, and Lawrence B. Smart1* Dept. of Horticultural Sciences, 2Dept. of Entomology, Cornell University, NYS Agricultural Experiment Station, Geneva, NY 3SUNY College of Environmental Science & Forestry, Syracuse, NY Funding provided by New York Farm Viability Institute to LB Smart.



La Mouche a Scie
Introduction
La mouche a scie (ou encore symphata) du saule nommée Nematus ventralis Say, (Hymenoptera : Tenthredinidae, sous-famille des Nematinae) est un ravageur commun des saules (Salix spp.) et des cotonniers (Populus spp.) en Amérique du Nord ainsi qu’en Europe, en Amérique du Sud et en Australie.
La mouche a scie (ou encore symphata) du saule est un membre non piqueur de la famille des guêpes. Les larves de la mouche a scie (ou encore symphata) du saule ressemblent à des chenilles et se nourrissent de jeunes feuilles tendres tout au long de l’été, ne laissant que la nervure médiane de chaque feuille. Les larves de la première génération éclosent en mai et se nourrissent jusqu’en juin, et une deuxième génération apparaît souvent en juillet et se nourrit jusqu’à la fin de l’été.
Des défoliations spectaculaires occasionnelles peuvent rapidement dépouiller une plante entière. Ces événements ne mettent généralement pas en danger la vie d’une plante plus âgée, mais peuvent sérieusement retarder la croissance d’une jeune plante.
Science
Les formes adultes des mouches à scie (ou encore symphata) du saule ressemblent aux guêpes et sont apparentés aux abeilles et aux guêpes, mais n’ont pas la taille manifestement resserrée des guêpes communes. La femelle adulte non piquante possède un ovipositeur saillant au bord dentelé qui sert à “scier” une fente où elle pond ses œufs à la fin du printemps. Les œufs éclosent en mai et les larves commencent à se nourrir des jeunes feuilles de saule. Les larves des mouches à scie (ou encore symphata) du saule ressemblent beaucoup aux chenilles et causent le plus de dommages au feuillage des saules arbustifs.
On peut les distinguer d’une chenille par le nombre de pattes (des pattes charnues situées derrière les trois paires de pattes avant). Les chenilles n’ont pas plus de quatre protubérances, alors que les larves des mouches à scie en ont six ou plus.
Les larves adultes, d’une longueur d’environ 18 mm, ont un corps noir ou noir verdâtre avec de grandes taches jaunes sur les côtés et une tête noire. Lorsqu’elles sont perturbées, les larves cambrent la moitié inférieure de leur corps en s’éloignant de la feuille, formant ainsi une forme en S distincte. Les larves matures tombent au sol, se métamorphosent et produisent une deuxième génération en juillet ou hivernent dans le sol et réémergent au printemps suivant. Il en résulte une ou deux générations par an.
Susceptibilité
Les larves du Nematus ventralis se nourrissent de nombreuses variétés de saules arbustifs, mais ont une préférence pour S. eriocephala, S. year. Les larves dépouillent rapidement un arbuste de ses jeunes feuilles et se déplacent vers des feuilles plus âgées si aucune autre nourriture n’est disponible.
Les larves éclosent souvent en grappes, il est donc très courant que retrouver de nombreuses larves de mouches a scie se nourrissent ensemble le long du bord d’une feuille. S. miyabeana, S. sachalinensis, S. purpurea et leurs hybrides. Les grandes épidémies sont rares, mais lorsqu’elles se produisent, elles peuvent provoquer une défoliation importante et réduire fortement la croissance.
Elles ne tuent généralement pas la plante. Une autre espèce de mouche a scie du saule, Nematus oligospilus, se trouve sur les saules, tels que S. alba, S. nigra et S. matsudana. Plusieurs autres espèces de mouches a scie s’attaquent au saule ; certaines produisent des galles sur les feuilles et d’autres creusent dans les tiges pour y déposer leurs œufs. D’autres espèces de mouche a scie se nourrissent des groupes particuliers de plantes, comme le mouche a scie de pommier européen qui se nourrit de feuilles de pommier, ainsi que la mouche a scie de pin qui se nourrit d’aiguilles de pin.
Gestion
Une épidémie de feuilles sawfly peut être nocif à la croissance du saule durant une saison de croissance, plus particulierement pendant l’année d’établissement. Les larves dépouillent rapidement un arbuste de ses jeunes feuilles et se déplacent vers des feuilles plus âgées si aucune autre nourriture n’est disponible. Les larves éclosent souvent en grappes, il est donc très courant que de nombreuses larves de mouche a scie se nourrissent ensemble le long du bord d’une feuille.
Si les conditions météorologiques sont favorables à la croissance, la deuxième génération peut être beaucoup plus importante que la première et doit être au tant que possible. La mouche a scie du saule passe l’hiver sous forme de pupe dans le sol et les populations localisées peuvent augmenter au cours des années successives, si elles ne sont pas maitrisées. Les populations de larves doivent être surveillées afin d’éviter les grandes épidémies localisées.
L’on peut physiquement retirer les larves si les populations sont petites. Les savons insecticides sont efficaces s’ils sont pulvérisés directement sur les larves. S’agissant des grandes épidémies, le spinosad (Conserve), l’acéphate (Orthene) et le carbaryl (Sevin) ont été efficaces pour réduire les populations de larves.
Ces trois produits ont été conçu pour être utilisés sur les arbustes ornementaux, mais aucun n’est principalement étiqueté pour les cultures bioénergétiques de saule. Votre expert local de la vulgarisation coopérative vous donnera plus amples informations pour un contrôle adapté à votre région.
Références sélectionnées
Greenwood, P. 2000. Pestes & maladies. Dorling Kindersley, New York. Smith, DR. 2003. Transactions Amer. Entomol. Soc. 129:1-45. Zinoviev, AG et Smith, DR. 2000. Proc. Entomol. Soc. Wash. 102:974-990. http://www.weeds.org.au/WoNS/willows/docs/Willow_Sawfly-Resource_Sheet3.pdf Kimberly D. Cameron1, Gregory M. Loeb2, Lawrence P. Abrahamson3, Cullen White1, et Lawrence B. Smart1* 1Dept. De Science Horticulturales, 2Dept. D’Entomologie, Université de Cornell, Station d’expérimentation agricole de l’État de New York Genève, NY 3SUNY Collège de Sciences Environnementales et Forestières, Syracuse, NY Financement fourni par le New York Farm Viability Institute à LB Smart